Celem projektu FUSAR jest opracowanie teoretycznych, metodycznych i organizacyjnych podstaw systemu wspierania decyzji w ochronie pszenicy przed fuzariozą kłosa.
Patogen
Grzyby rodzaju Fusarium (pol. sierpik) należą do gromady workowców (Ascomycota), rodziny gruzełkowatych (Nectriaceae). Są grzybami strzępkowymi, występującymi na całym świecie. Tworzą najczęściej obfitą, watowatą grzybnię o jaskrawych barwach. Plecha Fusarium składa się z przezroczystych lub zabarwionych septowanych strzępek, które są najczęściej cylindryczne i rozgałęzione. Tempo wzrostu grzybni zależy od gatunku, jednak najczęściej jest dosyć szybkie. Może ona przerastać podłoże, na którym rośnie, lub rozrastać się tylko na jego powierzchni. W przypadku Fusarium, jak i wielu innych gatunków grzybów, wyróżniamy dwa rodzaje grzybni: substratową, za pomocą której grzyb pobiera z podłoża wodę i substancje odżywcze, oraz powietrzną, służącą do oddychania.
U niektórych gatunków (F. oxysporum, F. fujikuroi, F. sambuccinum, F. verticillioides) strzępki grzybni mogą zrastać się w podkładki lub tzw. sklerocja, czyli twarde twory o różnym kształcie, służące za organy przetrwalnikowe, oraz owocniki, w których tworzą się zarodniki workowe. Trzonki zarodnikonośne, czyli konidiofory są, w zależności od gatunku, nierozgałęzione lub z rozgałęzieniami. Zakończone są fialidami, na których powstają zarodniki. Konidiofory mogą tworzyć się albo pojedynczo na strzępkach grzybni powietrznej, albo w tzw. sporodochiach – poduszeczkowatych splotach grzybni, na których ustawione są palisadowo. Sporodochia obserwowane gołym okiem są z reguły koloru pomarańczowego, rzadziej brązowe (u F. cerealis), zielone, kremowe lub niebieskawe (u F. solani). Śluzowate sporodochia, w których zarodniki i trzonki konidialne są zagłębione, nazywane są pionnotami.
Część gatunków Fusarium wytwarza w grzybni grubościenne, owalne lub kuliste chlamydospory, pełniące rolę przetrwalników. Mogą one występować pojedynczo, parami, w skupieniach lub łańcuchach. Różne gatunki Fusarium wytwarzają chlamydospory po różnym okresie czasu, np. F. culmorum wytwarza je w ciągu 2-5 tygodni, F. tricinctum po ponad 6 tygodniach, a F. avenaceum nie wytwarza ich wcale.
Fialidy (komórki zarodnikotwórcze) (zdj.1) można podzielić na monofialidy, mające jeden punkt konidiotwórczy, oraz polifialidy, mające kilka punktów tworzenia się zarodników. Fialidy mają najczęściej kształt butelkowaty lub cylindryczny. Charakter i kształt komórek zarodnikotwórczych jest ważną cechą identyfikacyjną.
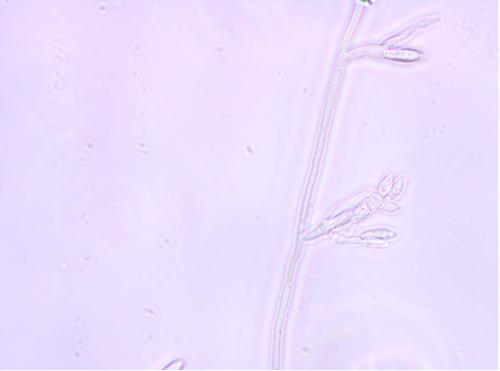
Zdj.1. Monofialidy F. graminearum, powiększenie 400x
U grzybów rodzaju Fusarium występują dwa rodzaje zarodników konidialnych: mikrokonidia oraz makrokonidia.
Mikrokonidia (zdj. 2-3) powstają wyłącznie w grzybni powietrznej. W porównaniu do makrokonidiów są niewielkie, z nielicznymi przegrodami lub bez przegród, kuliste, owalne, maczugowate lub eliptyczne czy wrzecionowate. Wytwarzane są na szczytach mono- lub polifialid pojedynczo, w łańcuchach lub w pseudo-główkach. Ich obecność (a wtedy ich budowa) lub brak jest ważną cechą diagnostyczną.
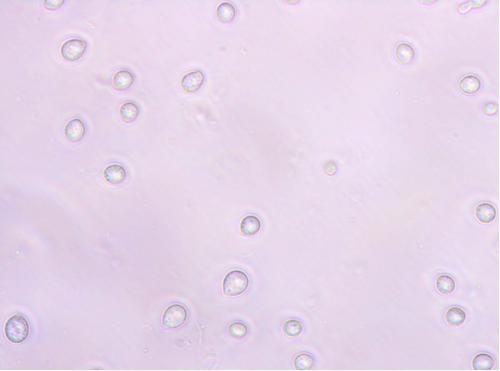
Zdj. 2. Mikrokonidia F. poae, powiększenie 400x
Zdj. 3. Mikrokonidia F. oxysporum, powiększenie 400x
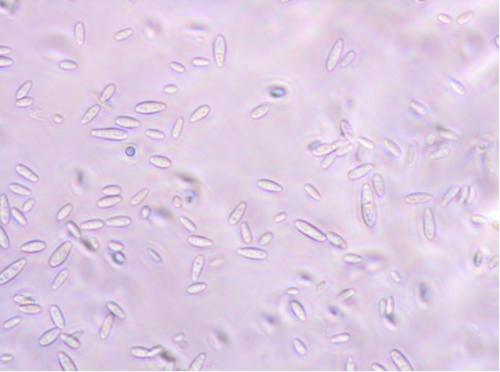
Makrokonidia (zdj.4) są zarodnikami wielokomórkowymi i mogą powstawać zarówno w grzybni powietrznej, jak i w sporodochiach. Najczęściej są wygięte sierpowato lub łukowato. Kształt i długość komórek szczytowych (apikalnych) oraz fakt występowania stópki lub wcięcia u komórek bazalnych są charakterystyczne dla danych gatunków. Również grubość i długość zarodników (w mikrometrach), grubość ściany komórkowej czy liczba i wyrazistość przegród mogą być zróżnicowane i stanowić podstawę do identyfikacji gatunku. Większość gatunków Fusarium wytwarza makrokonidia.
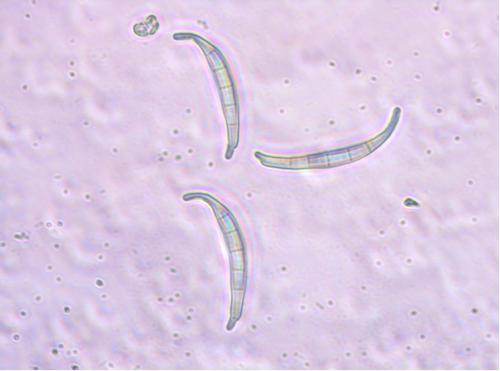
Zdj. 4. Makrokonidia F. equiseti, powiększenie 400x
Cześć gatunków Fusarium posiada stadium doskonałe (płciowe). W stadium tym grzyb wytwarza otocznie – perytecja, w których odbywa się zarodnikowanie workowe. Worki wytwarzane przez stadia doskonałe Fusarium są kształtu kulistego lub gruszkowatego, z otworem na szczycie. Szczepy Fusarium można podzielić na homotaliczne, czyli samopłodne, oraz heterotaliczne, w przypadku których do wytworzenia owocników niezbędne jest właściwe połączenie obydwu szczepów. Stadia doskonałe Fusarium są zaliczane do kilku rodzajów workowców: Gibberella, Haemonectria oraz Albonectria. Perytecja Giberella mają kształt owalny lub kulisty i w początkowym stadium rozwoju są bezbarwne. Z biegiem czasu stają się ciemnopurpurowe lub czarne. Worki znajdujące się w perytecjach są dość wąskie i maczugowatego kształtu. Zarodniki workowe (askospory) mają kształt sierpowaty z 1-3 przegrodami. Perytecja Haemonectria są czerwone lub żółte, mają kształt gruszkowaty albo kulisty i są płytko zagnieżdżone w podłożu. Worki mają kształt buławkowaty i zawierają prążkowane, elipsoidalne askospory z jedną przegrodą. Otocznie Albonectria mają barwę białą lub kremową i są kształtu elipsoidalnego. W workach znajduje się 4-8 zarodników z trzema przegrodami, o elipsoidalnym lub lekko wydłużonym kształcie.
Literatura
- Gagkaeva T., 2008. Introduction to Fusarium taxonomy. Laboratory of Mycology and Phytopathology, All-Russian Institute of Plant Protection, St. Petersburg, Rosja.
- Kwaśna H., Chełkowski J., Zajkowski P., 1991. Sierpik (Fusarium). Grzyby(Mycota), tom XXII.
- Ireta M. J., Gilchrist S., 1994. Fusarium Head Scab of Wheat (Fusarium graminearum Schwabe). Wheat Program Special Report 21b:4-6.
- Pitt J. I., Hocking A. D., 2009. Fungi and Food Spoilage. Springer , New York. S:96-98.
- Scherm B., Balmas V., Spanu F., Pani G., Delogu G., Pasquali M., Migheli Q., 2012. Fusarium culmorum: casual agent of foot rot and root rot and head blight on wheat. Molecular Plant Pathology 14(4):323-41.
- Stenglein S.A., 2009. Fusarium poae: a pathogen that needs more attention. Journal of Plant Pathology 91(1):25-36.








